Aufbau der Atome
|
|
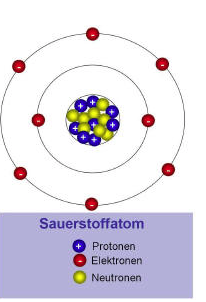
Ein Atom ist das kleinste Teilchen, welches auf chemischem Wege nicht weiter geteilt werden (griech.: atomos = das Unteilbare) kann. Ein Atom besteht aus dem Atomkern und der Atomhülle. Im Atomkern befinden sich die positiv geladenen Protonen und die neutralen Neutronen. Der Atomkern macht den Hauptteil des Gewichts eines Atoms aus. Um den Atomkern befindet sich die Atomhülle. In ihr bewegen sich die negativen Elektronen auf bestimmten Bahnen um den Atomkern herum. Da die Elektronen der Atomhülle und die Protonen des Atomkerns gegensätzlich geladen sind, ziehen sie sich gegenseitig an. Damit die Elektronen nicht in den positiv geladenen Atomkern stürzen, müssen sie sich in einer charakteristischen Geschwindigkeit um den Atomkern bewegen.
Die elektrostatischen Anziehungskräfte, die auf das Elektron einwirken, werden durch die Fliehkraft der Elektronen kompensiert (ausgeglichen). Das hier beschriebene Atommodell wurde von Ernest Rutherford 1911 veröffentlicht und von seinem Schüler Niels Bohr weiter ausgebaut. Alle zusammengesetzten Atomkerne enthalten sowohl Protonen als auch Neutronen (eine Ausnahme stellt das Wasserstoffatom dar, welches lediglich ein Proton als Atomkern besitzt). Da Atome nach außen hin elektrisch neutral sind, muss die Anzahl an positiven Ladungen im Atomkern gleich mit der Anzahl an Elektronen in der Atomhülle sein. Der Durchmesser eines Atomkerns macht nur ein zehntausendstel des Atomdurchmessers aus, er macht jedoch den Hauptteil des Atomgewichts aus.
Die Atomkerne (Atomkern = Nukleus) der Elemente bestehen alle aus den gleichen Kernbausteinen, den so genannten Nukleonen. Man unterscheidet zwischen den positiv geladenen Protonen und den elektrischneutralen Neutronen. Im Periodensystem der Elemente wird die Anzahl an Protonen durch die Kernladungszahl oder Ordnungszahl angegeben. Atome des gleichen Atoms weisen stets dieselbe Anzahl an Protonen (dieselbe Ordnungszahl) auf. Die Kernladungszahl gibt aus gründen der Elektroneutralität der Atome auch die Anzahl der Elektronen an. Die Masse eines Neutrons entspricht fast der Masse eines Protons. Das negativ geladene Elektron hingegen besitzt nur 1/1837 der Masse eines Protons. Folglich tragen Elektronen kaum zur Gesamtmasse eines Atoms bei. Die Masse eines Atoms ist somit fast ausschließlich im Atomkern lokalisiert. Die Gesamtzahl der Kernbausteine (Summe aus Protonen und Neutronen) wird deshalb auch als Massenzahl bezeichnet.
Wie aus der Tabelle zu entnehmen ist, unterscheiden sich die Massenzahlen immer durch ganze Zahlen. Betrachtet man jedoch das Periodensystem der Elemente, so stellt man fest, dass hier Massenzahlen mit mehreren Nachkommastellen angegeben sind. Der Grund dafür sind die Isotope der jeweiligen Elemente. Untersuchungen haben ergeben, dass die meisten Elemente in verschiedenen Arten auftreten. Dabei unterscheidet sich nur die Massenzahl und somit die Anzahl der Neutronen. Man bezeichnet Elemente, welche die gleiche Ordnungszahl aufweisen jedoch unterschiedliche Massenzahlen (und somit eine unterschiedliche Anzahl an Neutronen) als Isotope. Im Periodensystem wird nun eine relative Massenzahl angegeben. Damit ist gemeint, dass alle bekannten Isotope prozentual zu ihrer Häufigkeit in der Massenzahl berücksichtig werden. Beispielsweise setzt sich der Kohlenstoff aus 98,9% 12C, 1,1% 13C und in Spuren aus 14C Atomen zusammen. Die Atommasseneinheit bezieht sich auf 1/12 der Masse des 12C-Atoms.
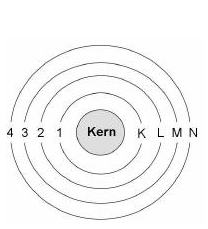
Die Atomhülle wird von den Elektronen gebildet, welche sich auf bestimmten „Bahnen“ um den Atomkern bewegen. Die Elektronen können sich dabei nicht in jedem beliebigen Abstand zum Atomkern bewegen sondern „umkreisen“ den Atomkern auf so genannten Schalen. Dabei entspricht eine Schale einer bestimmten Energiestufe. In eine bestimmte Energiestufe können jeweils nur eine bestimmte Anzahl von Elektronen aufgenommen werden. Die maximale Anzahl an Elektronen für eine Energiestufe ist durch 2n² gegeben. Dabei steht n für die Nummer der von Innen nach Außen gezählten Elektronenschalen. Im Periodensystem werden die Schalen auch mit K, L, M, N, O usw. –Schale bezeichnet. An einer chemischen Reaktion nehmen im Allgemeinen nur die Elektronen der äußersten Schale teil (Valenzelektronen). Die Anzahl an Valenzelektronen kann rechnerisch bestimmt werden. Geht man beispielsweise vom Brom mit der Kernladungszahl 35 aus, so besitzt das Atom 35 Protonen und damit auch 35 Elektronen. „Füllt“ man diese 35 Elektronen in die Schalen des Atoms, so können in der ersten Schale 2×1² = 2 Elektronen untergebracht werden. Es bleiben somit noch 33 Elektronen für die anderen Schalen. In der zweiten Schale finden 2×2² = 8 Elektronen Platz. Nachdem besetzen der zweiten Schale bleiben somit noch 25 Elektronen über. In der dritten Elektronenschale können 2×3² = 18 Elektronen untergebracht werden und es bleiben somit noch 7 Elektronen für die vierte Elektronenschale über. Brom besitzt somit 7 Valenzelektronen. |